IKZ-HAUSTECHNIK, Ausgabe 19/1998, Seite 28 ff.
SANITÄRTECHNIK

Mit Hilfe von Farbreaktionen werden Wasserinhaltsstoffe aufgespürt.
Wasserchemie, Wasseranalytik und Wasseraufbereitung
Wasseranalytik
Dr. Thomas Schwenkreis und Regina Malomsoky* Teil 2
Der Mensch ist von Kindesbeinen an daran gewöhnt, seine Umgebung mit seinen fünf Sinnen wahrzunehmen. Die stärkste Bedeutung haben dabei die Augen, weil durch sie - wie bei keinem anderen Sinnesorgan - eine enorme Menge an Informationen vermittelt werden können. Dessen ungeachtet müssen in einer technisierten Welt auch Informationen für wichtige Entscheidungen herangezogen werden, die nicht mit dem bloßen Auge erkannt werden können. Ein Hilfsmittel dafür ist die chemische Analytik, mit deren Hilfe Stoffe und deren Mengenanteile sichtbar gemacht werden. Beispielsweise ist die Behandlung der Diabetes mit Insulin ohne eine Überprüfung der Blutzuckerwerte mit analytischen Methoden nahezu undenkbar. Gerade bei der Untersuchung von Wasser spielt die Analytik eine besonders wichtige Rolle, da mit den Sinnen nur begrenzte Aussagen über die Wasserqualität möglich sind. Bildlich gesprochen ist also die Wasseranalytik die "Brille" mit der Wasser untersucht werden kann.
Werte aus Wasseranalysen sind Kriterien, auf deren Basis wichtige Entscheidungen getroffen werden. Dabei spielt neben der Durchführung vor allem die Auswahl der Analysenmethode eine große Bedeutung. Neben der möglichst hohen Genauigkeit der Methode und der Kenntnis möglicher Störeinflüsse ist vor allem die Reproduzierbarkeit und Vergleichbarkeit mit anderen Analysenergebnissen eine grundlegende Voraussetzung für "exakte" Untersuchungen von Wasser. Um dies zu gewährleisten wurden die Deutschen Einheitsverfahren eingeführt. Es handelt sich dabei um DIN-Normen, bei denen die Methode beschrieben ist, die für die verbindliche Erfassung eines Analysenparameters als Vorschrift dient. Diese Untersuchungsverfahren werden bei der gesetzlich vorgeschriebenen Überprüfung von Trinkwasser der Wasserversorgungsunternehmen angewandt.
| Membranfilter vor und nach dem Bebrüten. |
Für die Auslegung von kleineren Aufbereitungsanlagen und die schnelle Überprüfung vor Ort hat es sich aber auch bewährt, zum Teil mit anderen Verfahren und sog. Schnelltests zu arbeiten. Bei bestimmten Anwendungen sind die so erzielten Ergebnisse vollkommen ausreichend. Es muß aber immer berücksichtigt werden, welche Methode angewandt wurde und vor allem wie aussagekräftig das Ergebnis im Hinblick auf die zu treffende Entscheidung ist. Dies wird leider allzu oft vernachlässigt und Analysenwerte werden ohne weitere Überprüfung bis auf die letzte Kommastelle für "bare" Münze genommen. Für die Beurteilung einer Wasseranalyse reicht es jedoch nicht aus, die erhaltenen Werte insgesamt gut zu interpretieren, sondern auch der einzelne Wert selbst sollte einer Interpretation unterzogen werden. Für ein besseres Verständnis der analytischen Arbeitsweise und der Stärkung des Bewußtseins, daß Labore nicht nur für die schnelle Beschaffung von Analysenwerten gut sind, soll deshalb der Teil II Wasseranalytik der Serie Wasserchemie, Wasseranalytik und Wasseraufbereitung beitragen.
Wasseranalytik nach der Trinkwasserverordnung
Um die vorgeschriebene Qualität für Trinkwasser einzuhalten, sind nach der Trinkwasserverordnung regelmäßige Untersuchungen des Trinkwassers für die Unternehmer oder Inhaber einer Wasserversorgungsanlage vorgeschrieben. Der Umfang und die Häufigkeit der Analysen wird nach Anlage 5 geregelt. Es werden dabei folgende Untersuchungsformen unterschieden:
Untersuchung zur Überwachung der Desinfektion einmal pro Tag.
Laufende Untersuchung von Geruch, Trübung, Leitfähigkeit, Mikrobiologie und Überprüfung der Desinfektion alle 15.000 m3. Alle 30.000 m3 kann diese Untersuchung durchgeführt werden, wenn nicht desinfiziert wird oder der Gehalt an Desinfektionsmittel laufend aufgezeichnet wird.
Bei einer Trinkwasserabgabe bis 1000 m3 pro Jahr entfällt diese Untersuchung.
Periodische Untersuchungen werden mit dem Prüfumfang der laufenden Untersuchung und der zusätzlichen Prüfung auf Parameter der Anlage 2/Abschnitt I (Grenzwerte für chemische Stoffe, "toxische Stoffe") und Anlage 3 (zur Trinkwasseraufbereitung zugelassene Stoffe) durchgeführt.
Die Häufigkeit dieser Untersuchungen ist ebenfalls abhängig von der Wasserabgabemenge und erfolgt mindestens einmal im Jahr.
Bei den besonderen Untersuchungen kommt Anlage 4 (sensorische und physikalisch-chemische Kenngrößen) und Anlage 2/Abschnitt II (besondere Stoffe wie Antimon, Selen, Pflanzenschutzmittel, etc.) zum Tragen sowie von der zuständigen Gesundheitsbehörde angeordnete Sonderuntersuchungen. Die Anzahl der besonderen Untersuchungen wird von der zuständigen Behörde angeordnet.
Da Einzeluntersuchungen bei fortlaufender Prüfung entfallen, werden häufig On-line-Meßverfahren eingesetzt, die eine regelmäßige Kontrolle ermöglichen und mit deren Hilfe eine gleichbleibende Wasserqualität dokumentiert werden kann.
In den folgenden Absätzen wird auf die Bestimmung einzelner Parameter in der Wasseranalytik eingegangen und zum Schluß des Artikels werden die wichtigsten Methoden zusammengefaßt.
| Die Wirksamkeit von Enthärtungsanlagen kann sehr leicht durch Härtetitration überprüft werden. |
Mikrobiologie
Die Trinkwasserverordnung schreibt eine regelmäßige Prüfung des Trinkwassers auf Koloniezahl und E-coli bzw. coliforme Keime vor. Dies sind Bestimmungen, die in einem speziellen Labor mit mikrobiologischer Ausrüstung durchgeführt werden. Die mikrobiologische Untersuchung beginnt jedoch mit der Probenahme vor Ort [1]. Es dürfen nur sterile Probeflaschen verwendet werden und es müssen gewisse Probenentnahmeregeln eingehalten werden. Jeder hier von außen mit eingetragene, vermehrungsfähige Keim wird später bei der Untersuchung mitbestimmt. Wichtig ist weiterhin der schnelle Transport in ein Mikrobiologielabor bzw. eine ausreichende Kühlung der Wasserprobe. Für die Koloniezahlbestimmung wird normalerweise das Membranfilterverfahren verwendet. Die Probe wird steril über einen Membranfilter filtriert und dieser Filter in eine spezielle Nährlösung eingelegt. Zur besseren Auswertung besitzen diese Membranfilter meist ein Raster auf ihrer Oberfläche. Filter und Nährlösung kommen für 44 Stunden bei 22°C und bei 36°C in einen Brutschrank. In dieser Zeit bilden die Keime mit dem Auge zählbare Kolonien. Das Vorhandensein von E-coli und coliformen Keimen kann ebenfalls über Membranfilterverfahren und auch über Flüssigkeitsanreicherungen bestimmt werden. Die Auswertung erfolgt über Farbumschläge der Nährlösung bzw. Gasbildung. Hierzu sind andere Nährmedien, Bebrütungstemperaturen und -zeiten notwendig. Für weitere Differenzierung und Identifizierung von Keimen existieren verschiedene, oft nacheinander durchzuführende Verfahren, die im Regelfalle sehr zeitaufwendig sind.
Mittlerweile sind aber auch hier Schnelltests auf dem Markt erhältlich, mit denen ohne weitere Hilfsmittel die Gesamtkeimzahl abgeschätzt werden kann. Diese Tests ersetzen aber in keinem Falle die Untersuchung durch ein staatlich anerkanntes Labor, wenn es darum geht, ob ein Brunnenwasser als Trinkwasser verwendet werden kann oder nicht.
Härte
Schon für die richtige Dosierung des Waschmittels ist es nötig, die Gesamthärte bzw. den Härtebereich unseres Leitungswassers zu kennen. Mit Hilfe von handlichen Meßbestecken läßt sich die Härte über Titration (siehe Titration im letzten Kapitel) schon auf 1°dH genau bestimmen. Diese bestehen aus einem Probegefäß, das mit dem Untersuchungswasser gefüllt wird, und einem Tropffläschchen, das die Titrierlösung und den Indikator enthält. Nun werden dem Wasser solange Tropfen zugegeben, bis ein sehr gut erkennbarer Farbumschlag von rot auf grün erfolgt. Jeder verbrauchte Tropfen entspricht einem Grad deutscher Härte. Das beschriebene Verfahren nennt man komplexometrische Titration, da mit einem Komplexbildner als Titrierlösung gearbeitet wird. So läßt sich natürlich auch die Funktion vorhandener Enthärtungsanlagen sofort überprüfen oder eine Aussage über die Notwendigkeit einer Enthärtung des Trinkwassers treffen. Im Labor wird die Gesamthärte über die genaue Konzentration an Calcium- und Magnesiumionen, den Härtebildnern, ermittelt und berechnet.
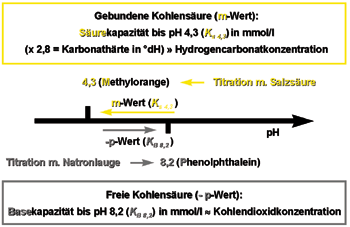
Säurekapazität bis zum pH-Wert 4,3 (KS4,3) / m-Wert. Zur Bestimmung der Karbonathärte muß ebenfalls eine Titration durchgeführt werden. Man benutzt dazu Indikatoren, die bei verschiedenen pH-Werten verschiedene Farben annehmen. So gibt es einen Indikator, das Methylorange (daher auch die früher verwendete Bezeichnung m-Wert), der genau bei pH 4,3 seine Farbe ändert. Wird dieser Indikator dem Trinkwasser zugesetzt, färbt es sich gelb. Nun wird solange eine sehr verdünnte Salzsäure, genauer gesagt eine 0,1 normale Salzsäure, zugegeben, bis der Indikator von gelb auf orange umschlägt. Der Verbrauch an Salzsäure in Milliliter entspricht der Säurekapazität in der Einheit mol/m3. Daraus lassen sich dann Karbonathärte und Hydrogenkarbonationenkonzentration errechnen.
Dieses Titrationsverfahren nennt man ebenso wie die nachfolgende Basenkapazitätsbestimmung eine Säure-Base-Titration.
Basenkapazität bis zum pH-Wert 8,2 (KB8,2) / minus p-Wert. Von großem Interesse ist der Gehalt an Kohlensäure im Leitungswasser, da diese die Abgabe von Schwermetallionen an das Trinkwasser fördert. Aus der Bestimmung der Basenkapazität läßt sich die freie Kohlensäure im Trinkwasser berechnen. Im Unterschied zur Säurekapazität wird als Titrationslösung 0,1 normale Natronlauge und als Indikator Phenolphthalein (minus p-Wert) verwendet. Das heißt, der pH-Wert im Meßwasser wird durch Laugenzugabe solange erhöht, bis der pH-Wert 8,2 erreicht wird. An diesem Punkt ändert sich die Farbe des Indikators von farblos nach rosa. Die verbrauchten Milliliter an Natronlauge müssen noch mit 44 multipliziert werden, um die freie Kohlensäure in mg/l zu erhalten. Diese Titration ist eine typische vor-Ort-Analyse, da durch Transport und längere Standzeiten der Wasserprobe Kohlensäure leicht aus dem Wasser ausgetrieben wird und so der gemessene Laborwert unter dem Originalwert liegen kann. Exakte Kohlensäurewerte lassen sich aus den genannten Gründen nur direkt an der Entnahmestelle messen.
Wie die Härtebestimmung und die Säurekapazitätsbestimmung kann die Basenkapazitätsbestimmung im Labor durch die Verwendung von Titrationsautomaten mit hoher Genauigkeit und geringem Arbeitsaufwand durchgeführt werden.
| Durch Korrosionen können Schwermetalle an Trinkwasser abgegeben werden. |
Leitfähigkeit
Die Leitfähigkeit gibt Aufschluß über den Salzgehalt des Trinkwassers. Sie wird in µS/cm angegeben. Je mehr gelöste Salze sich im Wasser befinden, desto höher ist die Leitfähigkeit, da Ionen in der Lage sind, elektrischen Strom zu leiten. Gemessen wird dies indirekt über den elektrischen Widerstand des Meßwassers mit einer Leitfähigkeitselektrode.
pH-Wert
Der pH-Wert eines Wassers wird üblicherweise mit einem pH-Meter und einer pH-Elektrode gemessen. Dies nennt man elektrometrische pH-Wert-Messung. Die Elektrode wird in das zu messende Wasser eingetaucht und der pH-Wert am Gerät abgelesen. Das pH-Meter muß in regelmäßigen Abständen mit einem oder mehreren Puffern von bekanntem pH-Wert (z.B. pH 7 und 4) geeicht werden. pH-Wert-Messungen ohne Gerätetechnik über Meßstreifen finden im Trinkwasser keinen Anwendungsbereich, da sie nur ungenügende Genauigkeit besitzen.
Gleichgewichts-pH-Wert
Um den Gleichgewichts-pH-Wert eines Wassers zu ermitteln, existieren verschiedene Methoden. Nach heutigen Erkenntnissen ist der Berechnungsmethode der Vorzug zu geben [2]. Diese ergibt den genauen Sättigungs-pH-Wert des Wassers. Um die Berechnung durchzuführen sind allerdings einige Mindestparameter und idealerweise ein geeignetes Rechenprogramm notwendig. Nach DIN 38404-10 benötigt man folgende Analysendaten: pH-Wert, Meß- und Bewertungstemperatur, Leitfähigkeit, KS4,3, Calcium, Magnesium, Sulfat, Nitrat, Chlorid, Natrium, Kalium, Phosphat und Ammonium.
Auch über einen praktischen Versuch läßt sich eine Aussage über die Aggressivität eines Wassers treffen. Laut Definition befindet sich ein Wasser im Gleichgewicht, wenn es weder Calcit (Calciumcarbonat) abscheidet noch zu lösen vermag. Dies benutzt man für folgendes Experiment: Zu dem Meßwasser, dessen pH-Wert bestimmt wurde, setzt man 2-3 g Calcit zu. Nach einer gewissen Kontaktzeit wird erneut der pH-Wert bestimmt. Hat es sich um ein calcitlösendes Wasser gehandelt, so liegt der jetzt gemessene pH-Wert höher als der Ausgangs-pH-Wert. Auch der KS4,3 ist angestiegen. Für calcitabscheidende Wässer gilt: Der End-pH-Wert sowie der KS4,3 werden unter den ursprünglich gemessenen Werten des Untersuchungswassers liegen. So kann auch schon vor Ort eine Aussage über die Kalkaggressivität gemacht werden.
Chlorid, Sulfat, Nitrat, Nitrit
Gerade wenn im Haushalt Kleinkinder und Säuglinge leben, machen sich viele Eltern Gedanken über den Nitratgehalt im Trinkwasser. Der analytische Nachweis von Nitrat im Trinkwasser kann sehr einfach über einen Stäbchenschnelltest geführt werden. Diese Stäbchen werden nur in das Wasser eingetaucht. Das Nitrat reagiert mit den chemischen Substanzen auf der Stäbchenoberfläche und das Stäbchen verfärbt sich. Je nach vorhandener Nitratmenge ist diese Farbe stärker oder schwächer und anhand einer Farbskala kann die Konzentration direkt abgelesen werden. Es gibt auch kombinierte Teststreifen, die das Vorhandensein von Nitrit durch eine Farbänderung gleich mit anzeigen.
Chlorid und Sulfat lassen sich zwar über Schnelltests vor Ort ebenfalls nachweisen, jedoch sind diese erfahrungsgemäß relativ ungenau. Für die Berechnung von Korrosionsquotienten, die bei der Auswahl eines geeigneten Installationsmaterials hilfreich sind, muß die Konzentration dieser Anionen genau ermittelt werden. Dies geschieht im Labor mit Hilfe von Ionenchromatographie (siehe Chromatographie im letzten Kapitel).
| Auszug aus einer Wasseranalyse. |
Eisen, Mangan, Zink, Kupfer
Die Metalle Eisen und Mangan sind in Brunnenwässern häufig anzutreffen. Für deren Analyse gibt es Schnellbestecke, die einfach zu handhaben sind. Über eine Reagenzienzugabe zum Brunnenwasser entsteht eine Färbung, die je nach Konzentration des vorhandenen Metalles stärker oder schwächer ausfällt. Die Färbung wiederum wird mit einer Farbkarte verglichen und die zugehörige Konzentration abgelesen. Diese Bestimmungsmethoden sind sehr hilfreich, da sofort an Ort und Stelle eine Aussage über die Notwendigkeit einer Enteisenung oder Entmanganung gefällt werden kann.
Eisen, Zink und Kupfer können aufgrund von Korrosionen des Rohrleitungsmaterials an das Trinkwasser abgegeben werden. Zur Überprüfung, ob die Richtwerte der Trinkwasserverordnung eingehalten werden, ist eine analytische Überprüfung sinnvoll. Dies ist zuverlässig durch eine Analyse per Atomabsorptionsspektrometrie (siehe AAS im letzten Kapitel) möglich. Mit AAS lassen sich Metalle noch im Spurenbereich nachweisen. Wichtig ist dies vor allem bei den sehr gesundheitsgefährdenden Stoffen wie zum Beispiel Blei und Arsen.
Kaliumpermanganatverbrauch und TOC
Kaliumpermanganat und TOC geben Hinweise über eine eventuell vorhandene organische Belastung des Trinkwassers. Diese kann beispielsweise bei Brunnenwässern durch den Eintrag von organischen Stoffen aus der landwirtschaftlichen Nutzung (Gülle) hervorgerufen werden. Mit dem TOC-Gehalt wird sämtlicher organischer Kohlenstoff erfaßt, mit dem Kaliumpermanganatverbrauch die Menge an Sauerstoff, die nötig wäre, um die im Wasser enthaltenen Inhaltsstoffe zu oxidieren. Es handelt sich in beiden Fällen um oxidative Aufschlüsse der Proben, die nur unter Hitzeeinwirkung stattfinden. Aus diesem Grunde sind keine einfachen Schnelltests erhältlich. Für die Messung sollte in jedem Fall ein Labor eingeschaltet werden.
Phosphat, Silikat
Phosphate und Silikate werden dem Trinkwasser häufig zum Korrosionsschutz zugesetzt. Zur Überprüfung der Dosierung ist eine Analyse derselben notwendig. Sie lassen sich am besten photometrisch erfassen. Wie bei der Eisen- und Mangananalyse werden dem Meßwasser Reagenzien zugegeben und die entstehende Färbung visuell mit einer Farbkarte verglichen. Ähnliches gilt für die Laboranalyse. Nur erfolgt die Auswertung der Farbintensität über ein Photometer (siehe Photometrie/Colorimetrie) und ist deshalb vom persönlichen Farbempfinden unabhängig.
Die Analyse von Polyphosphat, das für die Härtestabilisierung dosiert wird, erfordert allerdings einen vorhergehenden Aufschluß mit Säure. Dadurch wird das längerkettige Polyphosphat in Orthophosphat überführt und kann dann wieder wie dieses bestimmt werden.
Chlor
Chlor wird im Trink- und Brauchwasserbereich zur Desinfektion eingesetzt. Vor allem Schwimmbadwasser wird regelmäßig auf Chlor und gesundheitsschädliche Chlornebenprodukte (gebundenes Chlor) hin untersucht. Die Chlorbestimmung erfolgt vor Ort am einfachsten über ein Photometersystem, in dem alle benötigten Reagenzien bereits enthalten sind. Auch die Möglichkeit zur Bestimmung von pH-Wert, m-Wert, Aluminium, Temperatur und anderen Desinfektionsmitteln ist in diesen speziell für die Badewasseranalytik entwickelten Analysenkoffern meist mit enthalten.
Molybdän
Gängige Korrosionsinhibitoren für Heizungssysteme und geschlossene Kühlsysteme enthalten den Wirkstoff Molybdän. Durch Bestimmung des Molybdängehaltes im Kreislaufwasser kann sehr leicht auf ausreichenden Korrosionsschutz geprüft werden. Für diesen Einsatzzweck ist ein einfacher Testkit auf der Basis von Teststreifen meist ausreichend.
Methoden der Wasseranalytik
Zur Bestimmung einzelner Wasserinhaltsstoffe stehen eine Reihe von Methoden zur Verfügung. Jede Bestimmungsmethode hat, wie bereits angesprochen, Vorteile und Nachteile bezüglich ihrer Genauigkeit und möglichen Störungen. In diesem Kapitel sollen die wichtigsten Vorgehensweisen erklärt werden, die in der Wasseranalytik angewandt werden:
Titration
Alle Titrationsmethoden beruhen auf dem Prinzip durch Zugabe einer Titrationslösung bekannten Inhaltsstoffgehaltes den unbekannten Inhaltsstoff in der Prüflösung (z.B. eine Trinkwasserprobe) zu ermitteln. Zum Zutropfen der Titrationslösung wird zweckmäßigerweise eine Röhre mit Skalierung (die Bürette) verwendet, an der der Verbrauch der Titrationslösung abgelesen werden kann. Für die praktische Bestimmung vor Ort wird meist auch eine skalierte Spritze oder eine Tropfflasche verwendet. Unter Kenntnis der Stöchiometrie, d.h. wieviele Atome oder Moleküle der Titrationlösung mit den Atomen oder Molekülen in der unbekannten Trinkwasserprobe reagieren, kann nun der Gehalt in der Probe berechnet werden.
| Chromatogramme liefern detaillierte Informationen über die Art und Menge von Wasserinhaltsstoffen. |
Die Beendigung der chemischen Reaktion, die bei der Titration abläuft, muß natürlich möglichst gut erkannt werden, um rechtzeitig die Zugabe der Titrationslösung einzustellen. Der so erreichte Zustand wird der Titrationsendpunkt genannt. Die Endpunkterkennung erfolgt meist mit Hilfe von Indikatoren, d.h. Zusatzstoffen die den Endpunkt durch einen Farbumschlag zu erkennen geben. Für genauere Untersuchungen werden elektrochemische Methoden der Endpunkterkennung (z.B. pH-Wert-Messung) mit Laborgeräten, den sog. Titroprozessoren, angewandt. Aus dem bisher beschriebenen wird klar, daß die Genauigkeit der jeweiligen Methode von der Endpunkterkennung, der Ablesbarkeit des Titrationsverbrauches und der korrekten Zugabe abhängt. Es sind aber auch Störeinflüsse anderer Inhaltsstoffe zu berücksichtigen, die zum Teil durch bestimmte Kniffe behoben werden können. Falls dies nicht möglich ist, müssen andere Methoden angewandt werden. Um ein Beispiel zu nennen, stören bei der Härtebestimmung durch Titration Schwermetallionen, die durch Zusatz von Triethanolamin unterdrückt werden können.
Colorimetrie/Photometrie
In der Colorimetrie spielen - wie der Name schon sagt - Farbreaktionen eine wichtige Rolle. Im Gegensatz zur Titration, wo sie zur Endpunkterkennung eingesetzt werden, wird bei der colorimetrischen Methode die Intensität der Färbung direkt für die Gehaltsbestimmung genutzt.
Dieses Prinzip wird in den meisten Schnelltests genutzt, die sich durch ihre direkte Ablesemöglichkeit großer Beliebtheit erfreuen. Als Farbvergleichsskala werden Farbräder, Farbstreifen etc. eingesetzt. Die Färbung der Probe nach einer Reagenzienzugabe wird mit der Skala verglichen und die dazugehörige Konzentration abgelesen. Bei Teststreifen sind die Reagenzien schon auf ein saugfähiges Material aufgebracht. Durch einfaches Eintauchen der Reaktionszone in die Wasserprobe und anschließendem Vergleich mit einer Farbskala auf der Packung kann mit diesen Streifen äußerst unkompliziert eine Abschätzung von Wasserinhaltsstoffen durchgeführt werden.
Für die genaueren Messungen sollte jedoch zur Auswertung ein Photometer herangezogen werden. Durch die gefärbte Meßprobe wird ein Lichtstrahl einer bestimmten Wellenlänge geschickt. Durch die Probeninhaltsstoffe wird die Lichtintensität abgeschwächt und die Abschwächung (Absorption) wird über eine Photozelle gemessen. Photometer für den Laborbetrieb und für Messungen vor Ort mit fertigen Reagenziensätzen werden mittlerweile von einer Reihe von Herstellern angeboten.
Obwohl die einfache Handhabung für den Einsatz von Schnelltests und Photometern spricht, sind die angewandten Methoden besonders anfällig für Störungen durch andere Wasserinhaltsstoffe. Deshalb sollte vor einer Interpretation der Meßwerte stets auch ein Blick auf die Bedienungsanleitung der Tests geworfen werden, wo in der Regel mögliche Störgrößen angegeben sind. Für die meisten Anwendungen haben sich Schnelltests jedoch bewährt und sind eine große Hilfe, vor allem für die Bestimmung vor Ort.
Chromatographie
Während bei den bisherigen Methoden die Wasserinhaltsstoffe direkt in der Wasserprobe bestimmt werden, können mit chromatographischen Methoden die einzelnen Stoffe aufgetrennt werden und anschließend einzeln bestimmt werden. Somit kann der Einfluß von Störungen weitestgehend unterdrückt werden. Für die Wasseranalytik wird in erster Linie die Ionenchromatographie - eine spezielle Form der Chromatographie - eingesetzt. Als Trennsäulen werden hierbei Ionenaustauschermaterialien verwendet. Die Probe wird in eine Trägerflüssigkeit (Eluent) injiziert, die mit Hilfe einer Pumpe unter Druck über die Trennsäule geführt wird. Durch die Wechselwirkung der Ionen mit dem Material kommt es zu einer Auftrennung der Inhaltsstoffe. Die einzelnen Ionen können dann durch die Messung der Leitfähigkeit erfaßt werden. Als Meßresultat erhält man ein sog. Chromatogramm, das aus einzelnen Peaks (Schreiberausschläge) besteht. Jeder Peak steht für einen Inhaltsstoff, dessen Konzentration über die Peakfläche automatisch berechnet wird. Ionenchromatographie kann sowohl für Kationen wie Calcium, Magnesium, Natrium und Kalium angewandt werden als auch für Anionen wie Chlorid, Sulfat, Nitrat und Phosphat.
AAS (Atomabsorptionsspektroskopie)
Die AAS wird in der Wasseranalytik zur genauen Konzentrationsbestimmung von Metallen eingesetzt. Die Wasserprobe wird dabei bei einer Temperatur von bis zu 2800°C verdampft und in Atome zerlegt. Die extrem hohen Temperaturen werden entweder elektrisch oder durch eine Flamme erzeugt. Unter diesen Bedingungen können die gebildeten Atome Licht bestimmter Wellenlänge aufnehmen. Je mehr Atome des zu bestimmenden Metalls vorhanden sind, desto höher ist die Lichtaufnahme (Absorption). Als Meßergebnis erhält man wieder einen Peak, dessen Höhe der Absorption entspricht. Über Messungen der Absorption von Lösungen mit bekanntem Gehalt des Metalles kann man Eichkurven erstellen und die gesuchte Konzentration darauf ablesen. Diese Arbeit wird heutzutage jedoch von modernen Auswertungsprogrammen abgenommen.
* Dr. Thomas Schwenkreis, Mitglied der Fachgruppe Wasserchemie in der Gesellschaft deutscher Chemiker
Regina Malomsoky, Chemisch-Technische-Assistentin der Grünbeck Wasseraufbereitung GmbH
B i l d e r u n d G r a f i k e n : Grünbeck Wasseraufbereitung GmbH, Höchstädt a.d. Donau
Li t e r a t u r :
[1] Karl Höll, Wasser, 7. Auflage, Walter de Gruyter, Berlin 1986
[2] A. Grohmann: pH-Wert und Calcitsättigung des Wassers in: Die Trinkwasserverordnung. Erich Schmidt Verlag, Berlin 1976
[Zurück] [Übersicht] [www.ikz.de]