IKZ-HAUSTECHNIK, Ausgabe 5/1998, Seite 78 ff.
SANITÄRTECHNIK
Wasserchemie, Wasseranalytik und Wasseraufbereitung
Dr. Thomas Schwenkreis und Franz Kimmerle* Teil 1
Bei der Beurteilung von Geräten zur Wasseraufbereitung bzw. Wasserbehandlung treten immer häufiger Fragen zur Wirkungsweise der angepriesenen Geräte auf. Nicht selten werden dabei von Installateuren und Endverbrauchern Begriffe aus der Wasserchemie als unverständliches Fachchinesisch empfunden. Oft entsteht aber auch der Eindruck, daß bewußt chemische Phänomene von den Herstellern verwirrend dargestellt werden, um wissenschaftlichen Hintergrund vorzutäuschen.
Der Handwerker kann diese Aussagen nur schwer überprüfen. Deshalb sind hier Firmen mit fachlich kompetenten Kräften gefragt, Abhilfe zu schaffen. Aber auch bei Fachberatern mit soliden praktischen Kenntnissen wird Verwirrung ausgelöst durch die Ablösung eingeführter gängiger Begriffe durch SI-Einheiten. Ein anschauliches Beispiel hierfür ist der Ersatz von PS durch Kilowatt als Leistungsgröße. Obwohl diese Änderung schon lange zurückliegt, werden auch heute noch die meisten mit den Pferdestärken ihres Automobils mehr anfangen können als mit der Leistung in Kilowatt. Ähnlich verhält es sich mit Angaben wie der Karbonathärte in °dH in der Wasserchemie, die beispielsweise durch Säurekapazität bis pHS4,3 in mmol/l ersetzt. Letztendlich interessiert aber alle am Vertrieb von Wasseraufbereitungsgeräten Beteiligten nicht, was der "richtige" Ausdruck ist, sondern wie ein hohes Maß an Kundenzufriedenheit herzustellen ist. Für ein besseres Verständnis wasserchemischer Zusammenhänge und einer Verbesserung der fachlichen Beratung in der Praxis soll der Teil 1 Wasserchemie der Artikelserie Wasserchemie, Wasseranalytik, Wasseraufbereitung einen Beitrag leisten.
| Wichtige Grenzwerte der TrinkwVO. |
Wasserchemie
Trinkwasserverordnung (TrinkwVO) und Wasseranalyse
"Trinkwasser ist das wichtigste Lebensmittel; es kann nicht ersetzt werden (DIN 2000)". Dieser zentrale Satz erklärt sehr gut die Bedeutung einer klaren Regelung für die Trinkwasserzusammensetzung. Die vorgeschriebene Beschaffenheit wird deshalb durch die Trinkwasserverordnung TrinkwVO (aktuelle Ausgabe: Bundesgesetzblatt Nr. 66 vom 5.12.1990, S. 2612) erfaßt.
In der Trinkwasserverordnung wird im einzelnen aufgeführt, welche mikrobiologischen Parameter und welche Grenz- bzw. Richtwerte von Wasserinhaltsstoffen eingehalten werden müssen. Des weiteren werden die für die Aufbereitung zugelassenen Zusatzstoffe, deren obere Zugabemenge sowie der Grenzwert nach der Aufbereitung festgelegt. Bei den Grenzwerten stehen aber nicht ausschließlich gesundheitliche Aspekte im Vordergrund sondern auch praktische Gründe.
Zur Beurteilung einer Wasseranalyse wird zwischen der mikrobiologischen und physikalisch-chemischen Beschaffenheit des Wassers unterschieden. Die mikrobiologischen Eigenschaften entscheiden über die Qualität und die Eignung des vorliegenden Wassers als Trinkwasser im Hinblick auf Krankheitserreger.
Die physikalisch-chemische Beschaffenheit des Wassers entscheidet über:
- Gesundheitsgefährdung durch Grenzwertüberschreitung toxischer Stoffe. Unter diesem Gesichtspunkt kommt hauptsächlich Anlage 2 der TrinkwVO zum Tragen.
- Ablagerungen in Rohrleitungen und wasserbeschickten Aggregaten durch wasserunlösliche Stoffe wie Calciumcarbonat (Kalk, Kesselstein) oder Calciumsulfat (Gips).
- Korrosionen durch ungünstige Werte der Wasserinhaltsstoffe (Kohlensäure, Karbonathärte, Chloride, Sulfate, Nitrate, Sauerstoff etc.) für das jeweils verwendete Rohrleitungsmaterial.
- Störeffekte beim Wäschewaschen durch zu hohe Eisen- oder Manganwerte.
Hintergrundwissen, das über die Kenntnis der TrinkwVO-Grenzwerte hinausgeht, ist bei der Beurteilung von Wasseranalysen in der Praxis eine große Hilfe. Deshalb bemühen sich etablierte Firmen darum, ihren Kunden einen umfangreichen Laborservice zur Verfügung zu stellen.
| Blick in ein Labor mit moderner Analysetechnik. |
Mikrobiologische Eigenschaften
Trinkwasser muß frei sein von Krankheitserregern. Um dies zu überprüfen, werden jedoch nicht die aufwendigen Nachweismethoden für Krankheitserreger (z.B. Viren) durchgeführt, sondern mit der Bestimmung von Bakterien das Gefährdungspotential ermittelt. Zu diesem Zweck wird die Bakterienanzahl abgeschätzt und geprüft, ob Keime vorhanden sind, die auf eine mögliche fäkale Verunreinigung hindeuten. In der Praxis wird dazu die Koloniezahlbestimmung - d.h. die Anzahl der vermehrungsfähigen Bakterien pro Mengeneinheit - und Einzelnachweise auf Indikatoren wie coliforme Bakterien und Fäkalstreptokokken durchgeführt. Um eine mikrobiologisch einwandfreie Trinkwasserversorgung zu sichern, ist nach der Trinkwasserverordnung der Richtwert der Koloniezahl von 100 pro Milliliter bei den Bebrütungstemperaturen von 20°C und 36°C einzuhalten. Darüber hinaus dürfen coliforme Keime und Fäkalstreptokokken im Trinkwasser nicht nachgewiesen werden.
Das Trinken von mikrobiologisch verunreinigtem Wasser bedeutet übrigens nicht unbedingt das Auslösen von Krankheiten, da das Immunsystem beim gesunden Menschen durchaus eine gewisse Anzahl an Krankheitserregern bekämpfen kann. Gefährlich wird es aber dann, wenn aus dem verunreinigten Wasser leichtverderbliche Speisen hergestellt werden. Der beste Schutz vor verkeimtem Wasser bietet das Bakterienrückhaltevermögen der Böden, das allerdings regionale Unterschiede aufweisen kann. Die dabei ablaufenden Vorgänge sind sehr komplex. Es kann jedoch davon ausgegangen werden, daß ab einer Tiefe von 7 m keine Bakterien im Wasser zu finden sind. Oberflächenwässer aus Flüssen und Seen müssen im Gegensatz dazu entkeimt werden [1]. In Deutschland wird das Wasser dazu hauptsächlich versickert, während im Ausland auch höherer Chlorzusatz durchaus üblich ist. In der Technik wird die Filterwirkung der Böden nachgestellt durch den Einsatz von Mikro- bzw. Ultrafiltern, d.h. Filter mit Porengrößen kleiner 0,2 µm.
Härtebereich nach dem Waschmittelgesetz.

Physikalisch/Chemische Eigenschaften von Trinkwasser
Wasser ist eine Flüssigkeit, die aus den Elementen Wasserstoff und Sauerstoff im Molekülverhältnis 2:1 besteht. Bei der Reaktion von Wasserstoff und Sauerstoff wird sehr viel Energie frei (Knallgasreaktion). Wasser ist deshalb eine äußerst stabile Verbindung, die sich mit Hilfe von elektrischem Strom (Elektrolyse) wieder in die Elemente aufspalten läßt. Im Gegensatz zu anderen Flüssigkeiten besitzt Wasser besondere physikalische Eigenschaften, die auf die Ausbildung der sog. Wasserstoffbrücken zurückzuführen sind. Eine dieser Besonderheiten ist die hohe Oberflächenspannung, die in der Natur z.B. von Insekten (Wasserläufer) zum Laufen über der Wasseroberfläche genutzt werden. Äußerst wichtig aber ist das sog. Dichtemaximum bei 4°C. Durch die Tatsache, daß sich Wasser mit der höchsten Dichte am Grunde von Seen und Flüssen sammelt, wird gewährleistet, daß diese nicht zufrieren und Lebewesen an ihrem Grund im Winter überleben können. Die wichtigste chemische Eigenschaft des Wassers ist in erster Linie seine Fähigkeit, anorganische Stoffe (Salze) hervorragend zu lösen. Dadurch wird es erst möglich, daß z.B. wichtige Mineralstoffe bei der menschlichen Nahrungsaufnahme dem Körper zugeführt werden.
Im folgenden sollen die bedeutendsten chemischen Parameter, nach denen Trinkwasser eingestuft wird, näher erläutert werden.
pH-Wert
Der pH-Wert gibt Auskunft darüber, ob ein Wasser sauer oder alkalisch reagiert. pH-Werte kleiner als 7 werden als sauer eingestuft, pH-Werte größer 7 als alkalisch. Als greifbare Beispiele für saure Substanzen im alltäglichen Gebrauch sind Mineralwasser, Essig, Kalklöser, Zitronensaft oder Coca-Cola zu nennen. Alkalische oder basische Reaktionen werden durch die meisten Seifen und gewisse Reinigungsmittel hervorgerufen.
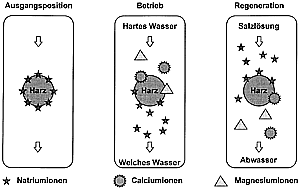
| Enthärtung durch Ionenaustausch. |
Härte
Die Härte eines Wassers ist bedingt durch seinen Gehalt an Calcium- und Magnesiumsalzen. Wasser mit hohem Calcium- und Magnesiumgehalt wird als hartes Wasser bezeichnet; Wasser mit wenig Calcium- und Magnesiumsalzen als weich. Als Gesamthärte in Grad deutscher Härte (°dH) wird die Konzentration der Erdalkalikationen Calcium und Magnesium bezeichnet, die in 10 mg Calciumoxid pro Liter Wasser ausgedrückt wird. Das bedeutet, 1°dH Gesamthärte entspricht 10 mg Calciumoxid pro Liter und das entspricht 0,179 mmol/l Erdalkaliionen (SI-Einheiten). Zur Berechnung der Gesamthärte muß die Summe der Erdalkalien (Calcium und Magnesium) in mmol/l folglich mit 5,6 multipliziert werden.
Rechenbeispiel:
3 mmol/l Erdalkalien (Calcium und Magnesium) x 5,6 = 16,8 °dH Gesamthärte.
Diesem Beispiel folgend wird unter der Calciumhärte der reine Gehalt an Calciumionen ausgedrückt, während mit der Magnesiumhärte ein Maß für die reine Magnesiummenge erhalten wird. Die Gesamthärte läßt sich auf Karbonathärte und Nichtkarbonathärte zurückführen. Unter Karbonathärte versteht sich der Anteil der Gesamthärte, dem Hydrogencarbonat als Anion zugrunde liegt. Die Hydrogencarbonatkonzentration läßt sich bei Wässern mit einem pH-Wert kleiner 8,0 über den bestimmbaren Wert der Säurekapazität bis pH 4,3 (KS4,3) ermitteln. Dieser Wert wurde früher auch m-Wert (gebundene Kohlensäure) genannt, nach SI-Einheiten ist jedoch Säurekapazität bis pH 4,3 (KS4,3) vorgeschrieben. Zur Berechnung der Karbonathärte wird die Säurekapazität bis pH 4,3 (KS4,3) mit 2,8 multipliziert.
Rechenbeispiel:
3 mmol/l KS4,3 x 2,8 = 8,4°dH Karbonathärte.
Für die Bildung von Kalkstein ist die Karbonathärte entscheidend, d.h. nur der Anteil der Gesamthärte, der als Karbonathärte vorkommt, kann im Warmwasser ausfallen. Der restliche Anteil der Gesamthärte, der sich nicht auf Hydrogencarbonat zurückführen läßt, wird Nichtkarbonathärte genannt (siehe 2.4). Somit ist die Gesamthärte GH die Summe aus Karbonathärte KH und Nichtkarbonathärte NK:
GH = KH + NK
Ionenaustauscher in Enthärtungsanlagen reduzieren die Gesamthärte und führen so zu einer starken Verminderung der Kalksteinbildung. Dabei werden die Erdalkaliionen gegen Natriumionen ausgetauscht. Durch diese Reduktion der Gesamthärte kann auf dem Papier eine Reduktion der Karbonathärte hervorgerufen werden. Es ist zu beachten, daß aber Hydrogencarbonat also gebundene Kohlensäure oder die Säurekapazität bis pH 4,3 nicht verändert wird. Ganz im Gegensatz dazu steht die Enthärtung durch Kalkmilchfällung, wie sie in Wasserwerken durchgeführt wird. Durch das Ausfällen von Kalk wird auch Hydrogencarbonat reduziert, d.h. die Karbonathärte auch "chemisch" und nicht nur "rechnerisch" niedriger.
Ausgefallenes Calciumcarbonat tritt in drei Erscheinungsformen auf, den sog. Kristallmodifikationen: Calcit, Aragonit und Vaterit. Die Modifikationen haben die gleiche chemische Zusammensetzung, unterscheiden sich aber in der Anordnung der Atome im Kristallgitter. Ein exakter wissenschaftlicher Nachweis, daß natürliche oder induzierte Magnetfelder bzw. elektrochemische Verfahren die Bildung dieser Modifikationen beeinflussen können, wurde bislang nicht erbracht. Es gibt jedoch Hinweise in der Literatur, die auf einen Einfluß von Eisenionen auf die Modifikationen hindeuten [2].
Calciumcarbonatbildung bei Temperaturerhöhung.
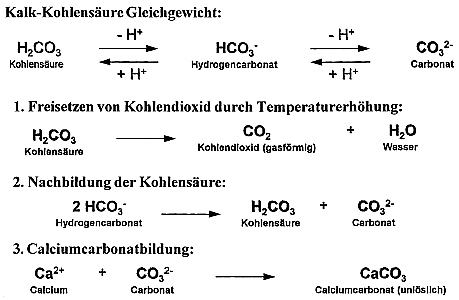
Kalk-Kohlensäuregleichgewicht, Kohlensäuren
Während die im vorhergehenden Kapitel vorgestellten Begriffe der Härte noch relativ gut verständlich sind und eine breite Akzeptanz erfahren, laufen die Vorstellungen über das sog. Kalk-Kohlensäure-Gleichgewichtes sehr weit auseinander. Letztendlich sind aber die mit Hilfe dieses Gleichgewichts beschreibbaren chemischen Vorgänge für die allseits bekannte Kalksteinbildung in Warmwassererzeugern verantwortlich. Um zu verstehen warum Kalk (Calciumcarbonat) bei Erwärmung von Wasser ausfällt, ist es interessant zu wissen, wie Kalk überhaupt ins Wasser kommt: Leitet man nämlich Kohlendioxid (CO2) in reines Wasser ein, liegt anschließend der Hauptteil physikalisch gelöst vor, während ein kleiner Teil durch eine Reaktion mit Wasser Kohlensäure bildet. Regenwasser, das aus der Luft Kohlendioxid aufgenommen hat, ist nun in der Lage, entsprechend seinem Anteil an Kohlensäure bzw. gelöstem Kohlendioxid, eine gewisse Menge an Calciumcarbonat (Calcit) aus Gesteinsschichten zu lösen. Dabei bildet sich Calciumhydrogencarbonat und es kommt zu folgenden drei Zuständen des durch das Gestein "behandelten" Wassers:
- Weiterer Kalkstein läßt sich lösen, d.h. das Wasser wird calcitlösend oder untersättigt bezeichnet. Diese Situation tritt vor allem in älteren Mittelgebirgen (Erzgebirge, Bayrischer Wald), deren Gesteinsschichten wenig Kalkstein (Calciumcarbonat) enthalten.
- Kalkstein fällt bereits bei Normaltemperaturen aus, d.h. das Wasser wird als calcitabscheidend oder übersättigt bezeichnt.
- Kalkstein läßt sich weder lösen noch ist eine calcitabscheidende Tendenz feststellbar. Man sagt: Das Wasser befindet sich im Zustand der Calcitsättigung. Der dazugehörige pH-Wert wird Gleichgewichts-pH-Wert genannt.
Die Gleichgewichtssituation wird nun stark von der Temperatur beeinflußt. Durch Erwärmen kann ein Wasser im Gleichgewichtszustand in den calcitabscheidenden Bereich gebracht werden, d.h. durch das Austreiben von Kohlendioxid bei höheren Temperaturen sind die Voraussetzungen für die Kalklöslichkeit nicht mehr gegeben. Kalkstein (Calciumcarbonat) wird aus Calciumhydrogencarbonat gebildet und setzt sich auf Rohr- und Boilerwänden nieder. Verhindern läßt sich dieser Vorgang, indem wie bereits ausgeführt, weniger Härte angeboten wird. Eine andere Methode besteht darin, das Wachstum der Kalkkristalle durch Impfung von Polyphosphat zu unterbinden. Die Kalkpartikel werden in Schwebe gehalten und ausgetragen.
Zum Schluß dieses Kapitels sollen die Vielzahl von existierenden Begriffen über die Kohlensäure näher erläutert werden:
Der Begriff gebundene Kohlensäure wurde bereits bei der Härte besprochen. Es handelt sich aus chemischer Sicht nicht um Kohlensäure sondern um Hydrogencarbonat.
Unter freier Kohlensäure wird das im Wasser gelöste Kohlendioxid (CO2) verstanden. Die freie Kohlensäure bei Wässern mit einem pH-Wert kleiner 8,0 entspricht dem durch Titration bestimmbaren Wert der Basenkapazität bis pH 8,2 (KB8,2). Dieser Wert wurde früher auch p-Wert genannt. Die freie Kohlensäure entscheidet - wie bereits erläutert - über die Tendez eines Wassers, Kalkstein bei der jeweiligen Wassertemperatur abzuscheiden.
Aggressive oder überschüssige freie Kohlensäure ist der Anteil der freien Kohlensäure, der noch in der Lage ist Kalk zu lösen. Experimentell wird dies durch einen Marmorlöseversuch ermittelt. Hohe Gehalte an freier überschüssiger Kohlensäure können auch Korrosionen hervorrufen. Nach der Trinkwasserverordnung sollte deshalb Trinkwasser, das mit metallischen Werkstoffen in Kontakt kommt, den Gleichgewichts-pH-Wert nicht um mehr als 0,2 pH-Einheiten unterschreiten.
| Ionenselektive Membranfiltration - eine zukunftsweisende Verfahrenstechnik. |
Chlorid, Sulfat und Nitrat
Chlorid, Sulfat und Nitrat sind die Anionen, die auf die Nichtkarbonathärte zurückzuführen sind. Werte, die über die Zugehörigkeit der Härte hinausgehen und somit an Natrium gebunden sind, werden als Neutralsalzgehalt bezeichnet. Wässer mit hohem Neutralsalzgehalt im Vergleich zur Karbonathärte, neigen zu Korrosionen bei verzinktem Stahl und hartgelötetem Kupfer. Durch die Berechnung von Korrosionsquotienten nach DIN 50930, können Einsatzgrenzen metallischer Werkstoffe festgelegt werden. Durch bestimmte Verfahren wie Ionenaustausch und ionenselektive Membranfiltration läßt sich das Verhältnis der Anionen Chlorid, Sulfat, Nitrat und Hydrogencarbonat in günstige Bereiche verändern. Von gesundheitlicher Relevanz sind die Werte für Nitrat und Nitrit. Es wurde ein Einfluß von Nitrat auf die Ausbildung der Methämoglobinämie (Schädigung von roten Blutkörperchen) bei Säuglingen beobachtet. Ausgelöst wird diese Krankheit durch eine Reaktion von Nitrat zu Nitrit im Körper [3]. Der Grenzwert nach TrinkwVO liegt deshalb bei 50 mg/l für Nitrat und 0,1 mg/l für Nitrit.
Zink, Kupfer
Beim Einsatz von metallischen Rohrleitungen kann es zur Abgabe von Metallionen an das Trinkwasser kommen. In der TrinkwVO sind deshalb Richtwerte für Zink und für Kupfer angegeben. In einem Großteil der deutschen Haushalte werden diese Werte nach Ausbildung schützender Deckschichten deutlich unterschritten. Höhere Werte können bei weichen, sauren Wässern, langen Stagnationszeiten und mangelhafter Rohrqualität auftreten.
Silikate, Phosphate und Polyphosphate
Zum Korrosionschutz und zur Härtestabilisierung in Trinkwasserleitungen sind Phosphate, Polyphosphate und Silikate in Lebensmittelqualität zugelassen. Silikate sind natürliche Stoffe, aus denen viele Mineralien aufgebaut sind. Der menschliche Körper benötigt Silicium, das in Form von Kieselsäure aufgenommen wird. Auch bei der Verwendung von Trinkwassermineralwirkstoffen entsteht nach der Dosierung Kieselsäure. Der Trinkwassergrenzwert für Silikat beträgt 40 mg/l als Si02. Phosphate sind Lebensmittelzusatzstoffe, die in einer Reihe von Lebensmitteln, wie z.B. Schmelzkäse, enthalten sind. Der Trinkwassergrenzwert beträgt 6,7 mg/l als P04. Die Mengen an Phosphat, die heutzutage über die Trinkwasseraufbereitung den Flüssen zugeführt werden, sind nicht zu vergleichen mit dem Eintrag, der früher durch Waschmittel verursacht wurde.
Eisen und Mangan
Eisen und Mangan sind Schwermetalle, die sehr häufig in Brunnenwässern anzutreffen sind und deren Grenzwerte eingehalten werden müssen. Im Trinkwasser auftretende erhöhte Eisen- und Mangangehalte sind normalerweise auf Korrosionen zurückzuführen. Mit speziellen Filtern werden diese Schwermetalle aus dem Trinkwasser entfernt.
Kaliumpermanganatverbrauch
Der Kaliumpermanganatverbrauch kann ein Hinweis für organische bzw. mikrobielle Belastung von Brunnenwässern sein. Durch den Einsatz von UV-Anlagen werden Mikroorganismen zuverlässig abgetötet und das Trinkwasser dadurch entkeimt. Für den Nachweis organischer Belastung hat sich auch der Parameter TOC (Gesamter organischer Kohlenstoff) bewährt, bei dem alle organischen Stoffe im Wasser in Form von Kohlendioxid nachgewiesen werden. Fortsetzung folgt.
* Dr. Thomas Schwenkreis, Mitarbeiter der Firma Grünbeck Wasseraufbereitung GmbH
Franz Kimmerle, Geschäftsführer der Kimmerle Verw. GmbH, Korschenbroich.
L i t e r a t u r :
[1] Karl Höll, Wasser, 7. Auflage, Walter de Gruyter, Berlin 1986
[2] J. L. Katz et al.: Magnetic Water Treatment: The Effect of Iron on Calcium Carbonate Nucleation and Growth, Langmuir 1989, 5, S. 861-867
[3] H. Petri: Nitrat und Nitrit in: Die Trinkwasserverordnung. Erich Schmidt Verlag, Berlin 1976
[Zurück] [Übersicht] [www.ikz.de]