IKZ-HAUSTECHNIK, Ausgabe 5/1996, Seite 40 ff.
HEIZUNG
Brennwert und Kondensat
Siegfried Heiermann
Brennwertgeräte können die in den Abgasen enthaltene Verdampfungswärme des bei der Verbrennung entstehenden Wasserdampfes teilweise nutzen. Da der Wasserdampf im Gerät kondensiert, wird zur Ableitung des Kondensates auch ein Anschluß an das Abwassernetz benötigt. In diesem Beitrag soll eine Antwort auf folgende Fragen gegeben werden:
1. Wieviel Wasser entsteht bei der Verbrennung von Erdgas?
2. Warum lohnt sich ein ölbefeuertes Brennwertgerät nicht?
3. Welchen Einfluß hat die Luftfeuchtigkeit auf die entstehende Wassermasse?
Um den Lesefluß nicht zu hemmen, sind notwendige Erläuterungen mit Ziffern z.B. 1) gekennzeichnet und am Schluß des Beitrages aufgeführt.
1. Wieviel Wasser entsteht bei der Verbrennung von Erdgas?
In der Berufsschule lernen die Auszubildenden der Sanitär- und Heizungstechnik, daß Erdgas eine Mischung verschiedener Kohlenwasserstoffgase mit geringem Anteil von Kohlendioxid und Stickstoff ist. Erdgas 1) besteht in der Hauptsache aus Methan mit dem chemischen Kurzzeichen CH4. Das Kurzzeichen gibt an, daß Methan aus Kohlenstoff (C) und Wasserstoff (H) besteht 2). 1 m3 Erdgas H enthält etwa 900 l Methan. Wenn man vereinfacht annimmt, daß 90% des Volumens auch 90% der Masse ausmachen, kann für diese 900 l Methan leicht festgestellt werden, wieviel Wasser bei der Verbrennung entsteht. Da alle anderen Brenngase und auch Heizöl ebenfalls aus Kohlenstoff und Wasserstoff bestehen, können die gewonnenen Erkenntnisse darauf übertragen werden.
Verbindet sich Methan mit Sauerstoff, so entsteht Wärme und die Verbrennungsprodukte Kohlendioxid und Wasser. Die chemische Reaktionsgleichung hierfür lautet:
CH4 + 2 O2 -> CO2 + 2 H2O (1)
Dies bedeutet ausführlich:
1 Molekül CH4 und 2 Moleküle O2reagieren zu 1 Molekül CO2 und 2 Moleküle H2O
Die Reaktionsgleichung darf man, wie in der Mathematik üblich, auf beiden Seiten mit demselben Faktor multiplizieren, z.B. Faktor 10:
10 Moleküle CH4 und 20 Moleküle O2reagieren zu 10 Moleküle CO2 und 20 Moleküle H2O
Sinnvoll ist aber der Faktor 6,022 · 1023. Der Grund ist, daß man in der Chemie die Stoffmenge von 6,022 · 1023 Teilchen ein Mol nennt 3). Damit sieht die Verbrennungsgleichung wie folgt aus:
1 mol CH4 und 2 mol O2reagieren zu 1 mol CO2 und 2 mol H2O (2)
![]()
900 Liter Methan wiegen 642,8 Gramm
16,0 g CH4 --- 36 g H2O
642,8 g CH4 --- x g H2O
1,0 g CH4 --- ![]()
![]()
Ein H2O-Molekül hat die Masse 18u. Damit wird ausgedrückt, daß das Molekül 18 mal schwerer ist als 1 H-Atom (1u = 1 Atommasseneinheit). Diese Masse ist unwahrscheinlich klein. Erhöht man jedoch die Zahl der Stoffteilchen auf 6,022 · 1023, dann hat jedes Mol der oben angegebenen Moleküle folgende Masse: 4), 5)
1 mol H2O = 18 g, 1 mol O2 = 32 g,
1 mol CO2 = 44 g, 1 mol CH4 = 16 g
Damit lautet die Verbrennungsgleichung:
16 g CH4 und 64 g O2 reagieren zu 44 g CO2 + 36 g H2O (3)
und als Volumengleichung (Gaszustand, 1013 mbar, 0°C):
22,4 Liter CH4 + 44,8 Liter O2 -> 22,4 Liter CO2 + 44,8 Liter H2O (4)
Durch Vergleich der Gleichungen (3) und (4) erkennt man, daß 22,4 Liter CH4 16 g wiegen, und bei der Verbrennung von 22,4 Liter CH4 36 g Wasser entstehen. - Damit ist die Bestimmung der Masse von 900 Liter CH4 und die bei der Verbrennung dieses Gasvolumens entstehenden Wassermasse möglich.
Bei der Verbrennung von 900 Liter Methan entsteht 1446,3 Gramm Wasser
Werden die gesamten Kohlenwasserstoffe von 1 m3 Erdgas H 1) bei der Berechnung zu Grunde gelegt, so entsteht 1,8 kg Kondensat, wenn die Abgase die Temperatur von 0°C haben. Umrechnungen auf andere Drücke und Temperaturen sind mit dem allgemeinen Gasgesetz möglich.
2. Warum lohnt sich ein ölbefeuertes Brennwertgerät nicht?
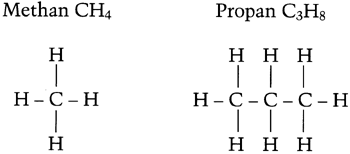
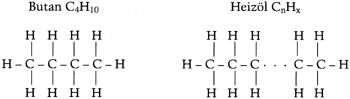
Da aus dem Wasserstoff das Verbrennungswasser entsteht, ist dieses um so mehr, je größer der Wasserstoffanteil eines Brennstoffes ist. Den Wasserstoffanteil eines Brennstoffes kann man an der chemischen Formel erkennen. Für einige Brennstoffe sind diese, mit der Strukturformel, unten dargestellt.
Man erkennt, daß das größtmögliche Verhältnis von Wasserstoff zu Kohlenstoff mit 4:1 bei Methan vorhanden ist. Bei allen anderen möglichen Kombinationen ist der Wasserstoffanteil geringer. Bei Heizöl mit dem Hauptanteil C16H34 ergibt sich ein Wasserstoff-/Kohlenstoffverhältnis von 2,1:1. Damit kann nur etwa die Hälfte an Wasser anfallen wie beim Erdgas H. Da weniger Wasser anfallen kann, ist auch der Unterschied von Heizwert und Brennwert geringer. In solch einem Falle lohnt sich nicht der Aufwand für ein Brennwertgerät.
Element | chem. Kurzzeichen | Atommasse in u |
Wasserstoff | H | 1 |
Kohlenstoff | C | 12 |
Sauerstoff | O | 16 |
Kupfer | Cu | 64 |
3. Welchen Einfluß hat die Luftfeuchtigkeit auf die entstehende Wassermasse?
Um Wasser aus der Luft ausfallen zu lassen, muß Luft abgekühlt werden. Dieses kann jeder an einer kalten, nicht gedämmten Wasserleitung, besonders in feuchten Räumen, feststellen. Die Feuchtigkeit der Luft fällt an der Oberfläche der Wasserleitung aus, sie kondensiert. An warmgehenden Leitungen fällt kein Kondensat an, weil warme Luft mehr Wasser aufnehmen kann als kalte Luft. Abkühlungs- und Aufheizvorgänge sowie das Wasseraufnahmevermögen der Luft bei den verschiedenen Temperaturen, kann man einem h-x Diagramm entnehmen.
Die Verbrennungsluft tritt in den Brennraum mit ca. 20°C ein. Das Abgas hat aber mindestens eine Temperatur von 40°C. Die Luft und auch das Abgas wird also erwärmt und damit trockener! Da die Luft aber trockener wird, ist das Ausfallen von Kondensat nicht möglich. Luft von 20°C kann max. 15 g Wasser aufnehmen, Luft von 40°C aber max. 48 g, bevor Wasser ausfällt. Also nimmt das Abgas und der Luftüberschuß Verbrennungswasser auf!
Die Fähigkeit von Luft und Abgas, Wasser aufzunehmen, vermindert somit das Ausfallen (Kondensieren) des Verbrennungswassers und verschlechtert den Wirkungsgrad, denn das Wasser wird als Dampf durch den Schornstein ins Freie transportiert. In der Praxis rechnet man daher nur mit etwa 1 Liter Kondensat je 1 m3 Erdgas.
Streng genommen gelten diese Überlegungen nur für den Luftüberschuß, doch das Wasseraufnahmevermögen von Luft und Abgas ist etwa gleich.
Molekül | Molekülmasse in u |
H2O | 2 · 1 + 1 · 16 = 18 |
O2 | 2 ·16 = 32 |
CO2 | 1 ·12 + 2 ·16 = 44 |
CH4 | 1 ·12 + 4 ·1 = 16 |
Erläuterungen:
1) Die Zusammensetzung des Erdgases kann man von den jeweiligen Gasversorgungsunternehmen erfahren. Im Mittel besteht Erdgas H aus folgenden Volumenanteilen von Gasen:
CO2 = 1,6%; N2 = 0,8%; CH4 = 86,0%; C2H6 = 8,2%; C3H8 = 2,3%;
C4H10 = 0,6%; sonstige CnHm = 0,5%
2) Den Nachweis dieser beiden Elemente kann man wie folgt durchführen: Man läßt Erdgas aus einem Brenner mit veränderbarer Erstluftzufuhr verbrennen und mindert stetig die Erstluft. Als Ergebnis erhält man eine lange, gelblich brennende Flamme, die zu rußen beginnt. Dieser Ruß ist der Beweis, daß Kohlenstoff im Gas enthalten sein muß. - Hält man über eine normal brennende Gasflamme ein kaltes, möglichst blankes Metall, dann kann man an diesem Metall Wassertropfen beobachten.
Diese zwei Grundversuche sind auch mit jeder Schweißflamme durchführbar, denn das Schweißgas Acetylen (C2H2), besteht wie fast alle Brenngase aus Kohlenstoff und Wasserstoff.
3) Das Mol, genauer Gramm-Molekül, gibt von jeder chemischen Verbindung die Menge in Gramm an, die ihrem Molekulargewicht entspricht. Bei Gasen spricht man auch von einem Molvolumen, das ist das von einem Mol Gas bei Normalbedingungen, d.h. 0°C und 1013 mbar, eingenommene Volumen. Dieses Molvolumen beträgt für alle Gase 22,4 Liter. Dieser Zusammenhang wurde von Avogadro (ital. Physiker, 1776-1856) zum ersten Male festgestellt.
Die Einheit Mol mit den Einheitenzeichen mol, bzw. mmol wird auch bei der Angabe der Wasserhärte benutzt. Hierbei geben die Anzahl der Calcium- oder Magnesium-Ionen in 1 m3 Wasser die Wasserhärte an. (Veraltet °dh = "Deutscher Grad").
Eine bekanntere Einheit ist die Längeneinheit Meter mit dem Einheitenzeichen m und den daraus abgeleiteten Einheiten dm, cm und mm.
Mit der Einheit Mol kann man z.B. umrechnen, wieviel mmol Kupfer nach der Trinkwasserverordnung in einem Liter Wasser enthalten sein darf, wenn 3 mg Kupfer in einem Liter Wasser zugelassen sind.
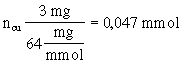
4) Das Wiegen vieler Teile und das Bestimmen der Anzahl dieser Teile aus der Wägung wird in Sparkassen durchgeführt, wenn eine große Anzahl Münzen gezählt werden müssen. Zuerst wird nach Münzart sortiert, dann die sortierten Münzen gewogen. Die Anzahl der Münzen wird dann dadurch ermittelt, daß jede Masse sortierter Münzen durch die Masse einer Münze gleicher Sorte geteilt wird.
5) Da ein Mol das 6,022·1023-fache eines Moleküls wiegt, kann man die Molmasse bestimmen, wenn man die Masse der Atome eines Moleküls kennt. Das leichteste Atom ist das des Wasserstoffs, eines der schwersten ist Radium (ca. 226 mal schwerer als Wasserstoff).
Für einige Elemente sind die Atommassen in der Tabelle aufgeführt, und die Molekülmassen der bei der Verbrennung auftretenden Moleküle berechnet.
[Zurück] [Übersicht] [www.ikz.de]
